calor
el calor esta definido como la forma de energía que se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentra en distinta temperaturas, sin embargo en termodinámica generalmente el termino de calor se refiere simplemente a la transferiencia de energía.
cambios de estado de la materia
-de estado solido a liquido, llamado fusión.
-de estado liquido a solido, llamado solidificación.
-de estado solido a gaseoso, llamado sublimación.
-de estado gaseoso a liquido, llamado condensación.
-de estado solido a gaseoso, llamado sublimación progresiva.
-de estado gaseoso a solido, llamado sublimación regresiva.
temperatura
en física se refiere a una magnitud escalar relacionada con la energía interna de un sistema termodinamico.
mas específicamente esta relacionada directamente con la pare de la energía interna conocida como "energía cinetica" qe es la energía asociada a las particla en movimiento.
ley de Stefan
La ley fue deducida en 1879 por el físico austriaco Jožef Stefan (1835-1893) basándose en las mediciones experimentales realizadas por el físico irlandes John Tyndall y fue derivada en 1884 a partir de consideraciones teóricas por Ludwig Boltzmann (1844-1906) usando la termodinámica. Boltzmann consideró un cierto ideal motor térmico con luz como fuente de energía en lugar de gas. La ley es muy precisa sólo para objetos negros ideales , los radiadores perfectos, llamados cuerpos negros; funciona como una buena aproximación para la mayoría de los cuerpos grises. Stefan publicó esta ley en el artículo «Über die Beziehung zwischen der Wärmestrahlung und der Temperatur» (Sobre la relación entre la radiación y la temperatura térmica) en el Boletín de las sesiones de la Academia de Ciencias de Viena.
formulas:
E= o* t (exponente 4)
- de la superficie y sigma es la constante de Stefan Boltzmann:
o= 5.67*10 (exponenete -8)
La potencia emisiva superficial de una superficie real es menor que el de un cuerpo negro a la misma temperatura y está dada por:
E= e* o* t(exponente 4)
Donde epsilon (ε) es una propiedad radiactiva de la superficie denominada emisividad. Con valores en el rango 0 ≤ ε ≤ 1, esta propiedad es la relación entre la radiación emitida por una superficie real y la emitida por el cuerpo negro a la misma temperatura. Esto depende marcadamente del material de la superficie y de su acabado, de la longitud de onda, y de la temperatura de la superficie.
potencia radiada:
p=o*e*a*t(exponente 4)
p= potencia radiada en wats.
o= constante de Stefan 5.67x10(exponente menos 8)
e= constante de emitividad.
t= temperatura en grados kelvin.
ejemplo:
cual es la potencia radiada por un cuerpo a 250 grados centígrados, con un área de 50cms cuadrados.
T=250C*>523 K*
A=50 CMS2
e=1
(5.67X10EXP-8) (1) (523 EXP4)=2121.093
(50) (7.48)
Rapidez de radiación:
se define como la energía radiante que emite un cuerpo por unidad de área expresada matemáticamente como:
R=e* o* t (exponente 4)
ejemplo:
calcular la rapidez de radiación de un cuerpo que se encuentra a 150 grados centígrados.
datos:
T=150C*> 423K*
O= 5.67X10(exponente menos 8)
e=1
(1.91x10 exp 10) (5.67x10 exp menos 8) (1) =1082.97
R=1082.97
temperatura de radiación:
T= (/R/)/e X o
dilatación aérea
Cuando un área o superficie se dilata, lo hace incrementando sus dimensiones en la misma proporción. Por ejemplo, una lámina metálica aumenta su largo y ancho, lo que significa un incremento de área. La dilatación de área se diferencia de la dilatación lineal porque implica un incremento de área.
El coeficiente de dilatación de área es el incremento de área que experimenta un cuerpo de determinada sustancia, de área igual a la unidad, al elevarse su temperatura un grado centígrado. Este coeficiente se representa con la letra griega gamma (γ). El coeficiente de dilatación de área se usa para los sólidos. Si se conoce el coeficiente de dilatación lineal de un sólido, su coeficiente de dilatación de área será dos veces mayor:
So=área inicial.
β = coeficiente de dilatación.
∆T= diferiencias de temperatura.
tabla de materiales en dilatación aerea
sustancia coeficiente de dilatación aérea
1-hierro 1- 23.4x10(exponente menos 6)
2-aluminio 2- 44.8x10(exponente menos 6)
3-cobre 3- 33.4x10(exponente menos 6)
-4-plata 4- 36.6x10(exponente menos 6)
5-plomo 5-54.6x10(exponente menos 6)
6-niquel 6- 25x10(exponente menos 6)
7-acero 7- 23x10(exponente menos 6)
8-zinc 8- 70.8x10(exponente menos 6)
9-vidrio 9- 14.6x10(exponente menos 6)
10-oro 10- 3x10(exponente menos 6)
EJEMPLO:
A una temperatura de 13 grados centígrados una placa de zinc tiene n área de 1.5 metros cuadrados
¿Cuál será su temperatura final al aumentar 32 grados centígrados?
datos:
B= 70.8X10(exponente menos 6)
To= 13 grados centígrados.
TF= 32 grados centígrados.
Ao= 1.5 mts.
AF= Ao ( 1+B) (Tf-To)
AF=1.5(70.8+1) (32-13)
AF= 1.5(71.8) (19)
AF= 2046.09
dilatación lineal
 , es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura
, es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura 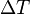 a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior.
a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior.formula para dilatación lineal:
L = Lo (1 + α ∆T)
tabla de materiales en dilatación lineal
sustancia coeficiente de dilatación lineal
1-hierro 1- 11.7x10(exponente menos 6)
2-aluminio 2- 22.4 x10(exponente menos 6)
3-cobre 3- 16.7x10(exponente menos 6)
4-plata 4- 18.3x10(exponente menos 6)
5-plomo 5- 22.3x10(exponente menos 6)
6-niquel 6-12.5x10(exponente menos 6)
7-acero 7- 11.5x10(exponente menos 6)
8-zinc 8- 35.4x10(exponente menos 6)
9-vidrio 9- 7.3x10(exponente menos 6)
10-oro 10- 1.5x10(exponente menos 6)
Ejemplo:
a una temperatura de 15 grados centígrados una varilla de hierro tiene una logitud de 5 mt ¿Cuál será su longitud final al aumentar la temperatura 25 grados centígrados?
datos:
To=15 c*
Tf=25 c*
a=11.7x10(exponente menos 6)
Lo= 5 mt.
Lf= 5 (1+11.7x10(exponente menos 6)) (25-15)
Lf=5 (12.7x10(exponente menos6 *10)
Lf= 63.5 cms.
dilatación cubica o volumétrica
Es el coeficiente de dilatación volumétrico, designado por αV, se mide experimentalmente comparando el valor del volumen total de un cuerpo antes y después de cierto cambio de temperatura como, y se encuentra que en primera aproximación viene dado por:
Experimentalmente se encuentra que un sólido isótropo tiene un coeficiente de dilatación volumétrico que es aproximadamente tres veces el coeficiente de dilatación lineal. Esto puede probarse a partir de la teoría de la elasticidad lineal. Por ejemplo si se considera un pequeño prisma rectangular (de dimensiones: Lx, Ly y Lz), y se somete a un incremento uniforme de temperatura, el cambio de volumen vendrá dado por el cambio de dimensiones lineales en cada dirección:
formula de dilatación cubica o volumétrica
V = Vo (1 + γ ∆T)
tabla de materiales en dilatación cubica o volumétrica
sustancia coeficiente de dilatación cubica
1-hierro 1-35.1x10(exponente menos 6)
2-aluminio 2- 67.2x10(exponente menos 6)
3-cobre 3-50.1x10(exponente menos 6)
4-acero 4- 34.5x10(exponente menos 6)
5-vidrio 5- 21.9x10(exponente menos 6)
6-mercurio 6- 182x10(exponente menos 6)
7-glicerina 7- 485x10(exponente menos 6)
8-alcohol solido 8- 746x10(exponente menos 6)
9-petróleo 9- 895x10(exponente menos 6)
10-gases 10- 1/273(exponente menos 6)
EJEMPLO:
datos:
To= 750k*> 497c*
Ao=1.8m * 0.65cm> 1.17mt
Tf= 140 f*> 60c*
y(vidrio) = 14.6x10(exponente menos 6)
Af= Ao (1+y) ( Tf- To)
1+0.0063802 ( 437)
1.0063802* 1.17
Af=1.177464834
Af=1.177464834
capacidad calorifica
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. En una forma más rigurosa, es la energía necesaria para aumentar la temperatura de una determinada sustancia en una unidad de temperatura.Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende, no solo de la sustancia, sino también de la cantidad de materia del cuerpo o sistema; por ello, es característica de un cuerpo o sistema particular. Por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de un vaso de agua. En general, la capacidad calorífica depende además de la temperatura y de la presión.
La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo «para almacenar calor. y es el cociente entre la capacidad calorífica y la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.
formula de capacidad calorífica
C= A x Q// (TF- To)
c= capacidad calorífica.
Q= cantidad de calor.
TF= temperatura final.
To= temperatura inicial.
ejemplo:
un buen ejemplo de capacidad calorifica es el agua. esta tiene la capacidad de absorver mas rápido lo liquido que el material solido.
la capacidad calorífica no debe de ser confundida con el calor especifico.
1gr de agua= 1 caloria
calor especifico
El calor específico es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad. En general, el valor del calor específico depende del valor de la temperatura inicial.[Se le representa con la letra
 (minúscula).
(minúscula).De forma análoga, se define la capacidad calorífica como la cantidad de calor que hay que suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la letra
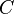 (mayúscula).
(mayúscula).Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es
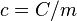 donde
donde 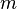 es la masa de la sustancia.
es la masa de la sustancia.
tabla de calor especifico:
sustancia calor especifico ( ce )
1-agua 1-1.00
2-hielo 2- 0,50
3-vapor 3- 0.48
4-hierro 4-0.113
5-cobre 5-0.093
6-aluminio 6-0.217
7-plata 7-0.056
8-vidrio 8-0.199
9-mercurio 9-0.035
10-plomo 10-0.031
11-aire 11-0.337
sustancia calor especifico ( ce )
1-agua 1-1.00
2-hielo 2- 0,50
3-vapor 3- 0.48
4-hierro 4-0.113
5-cobre 5-0.093
6-aluminio 6-0.217
7-plata 7-0.056
8-vidrio 8-0.199
9-mercurio 9-0.035
10-plomo 10-0.031
11-aire 11-0.337
EJEMPLO:
datos:
Q=???
M=700gr
Ce (pb)= 0.310
To= 97F*> 36.11c*
Tf= 180f*> 82.22 C*
Q= 700* 0.310* (82.22-36.11)
Q= 217* 46.11
Q=10005.87
CALOR LATENTE
El calor latente es la energía requerida por una cantidad de sustancia para cambiar de fase, de sólido a líquido (calor de fusión) o de líquido a gaseoso (calor de vaporización). Se debe tener en cuenta que esta energía en forma de calor se invierte para el cambio de fase y no para un aumento de la temperatura.
Desde antiguo se usaba la expresión calor latente para referirse al calor de fusión o de vaporización. Latente, en latín, quiere decir escondido, y se llamaba así porque, al no notarse un cambio de temperatura mientras se produce el cambio de fase (a pesar de añadir calor), éste se quedaba escondido. La idea proviene de la época en la que se creía que el calor era una sustancia fluida denominada calórico. Por el contrario, el calor que se aplica cuando la sustancia no cambia de fase, aumenta la temperatura y se llama calor sensible.
Cuando se aplica calor a un trozo de hielo, va subiendo su temperatura hasta que llega a 0 °C (temperatura de cambio de estado); a partir de ese momento, aunque se le siga aplicando calor, la temperatura no cambiará hasta que se haya fundido del todo. Esto se debe a que el calor se emplea en la fusión del hielo. Una vez fundido el hielo la temperatura volverá a subir hasta llegar a 100 °C; desde ese momento, la temperatura se mantendrá estable hasta que se evapore toda el agua.
El concepto fue introducido alrededor de 1762 por el químico escocés Joseph Black.
Esta cualidad se utiliza en la cocina, en refrigeración, en bombas de calor y es el principio por el que el sudor enfría el cuerpo.
FORMULA DE CALOR LATENTE:
% Q 0!Tf +Q cambio de fase +Q Th!0%=% Qa+c %
TABLA DE SUSTANCIAS DE CALOR LATENTE PARA VARIOS PROCESOS DE CAMBIO DE ESTADO:
Sustancia
|
T fusión ºC
|
Lf ·103 (J/kg)
|
T ebullición ºC
|
Lv ·103 (J/kg)
|
Hielo (agua)
|
0
|
334
|
100
|
2260
|
Alcohol etílico
|
-114
|
105
|
78.3
|
846
|
Acetona
|
-94.3
|
96
|
56.2
|
524
|
Benceno
|
5.5
|
127
|
80.2
|
396
|
Aluminio
|
658.7
|
322-394
|
2300
|
9220
|
Estaño
|
231.9
|
59
|
2270
|
3020
|
Hierro
|
1530
|
293
|
3050
|
6300
|
Cobre
|
1083
|
214
|
2360
|
5410
|
Mercurio
|
-38.9
|
11.73
|
356.7
|
285
|
Plomo
|
327.3
|
22.5
|
1750
|
880
|
Potasio
|
64
|
60.8
|
760
|
2080
|
Sodio
|
98
|
113
|
883
|
4220
|
EJEMPLO:
DATOS:
DATOS:
Mc = 0.04709 kg
Mc + Ma = 0.31887 kg
Ma = 0.2717 kg
Vaso amarillo = 0.03224 kg
Mh = 0.04522 kg
2.
Tc = 22.8 ºC
Ta = 22.8 ºC
Th = -1.3 ºC
Tf = 18.9 ºC
3.
% Q 0!Tf +Q cambio de fase +Q Th!0%=% Qa+c %
4.
2.5376 x 10 -1 + 0.01298 Lh = 1.1003
0.01298 Lh = 1.1003 - 2.5376 x 10 -1
Lh = 8.4654 x 10 -1 = 65.2223 kcal/kg
0.01298
5.
Error % = 79.7 - 65.2223 x 100 = 18.16%
Q=79.7
calor latente de fusion
Para determinar el calor de fusión del hielo se pueden seguir dos procedimientos:
- Se mide la energía (potencia por tiempo) suministrada por un calentador eléctrico a una masa m de hielo a 0º C que se convierte en agua a la misma temperatura.
- Se introduce una masa m de hielo a un calorímetro con agua a una temperatura T ligeramente por encima de la temperatura ambiente Ta y se agita la mezcla hasta que el hielo se funde completamente. Se elige la masa m del hielo de modo que la temperatura Te de equilibrio esté ligeramente por debajo de la temperatura ambiente, es decir, de modo que T-Ta≈T-Te. De este modo, el calor cedido al ambiente en la primera etapa de la experiencia se compensa con el calor ganado en la segunda etapa.
En la experiencia que se describe a continuación, se emplea el procedimiento de las mezclas pero no se tiene en cuenta las pérdidas o ganancias de calor entre el calorímetro y el medio ambiente.
Una masa ma de agua a la temperatura inicial Ta se mezcla con una masa mh de hielo a 0º C en un calorímetro. La mezcla de agua y hielo se agita hasta que se alcanza una temperatura final de equilibrio Te.
calor latente de evaporación
Para medir el calor de vaporización se coloca un recipiente metálico con una masa m de agua sobre un hornillo eléctrico de potencia P.
Sea la temperatura inicial del agua es Ta. A medida que transcurre el tiempo se va elevando la temperatura del agua, hasta que entra en ebullición a 100 ºC. Anotamos el tiempo t1.
El agua se evapora, disminuyendo el nivel de agua en el recipiente hasta que toda el agua se ha convertido en vapor. Anotamos el tiempo t2 que transcurre desde el comienzo de la ebullición hasta que se consume el agua.
Ejemplo:
- Potencia 1000 W
- Masa de agua: m=200 g
- Temperatura inicial, y Ta=20ºC
- El agua alcanza la temperatura de 100º C en el instante t=78 s.
- El agua se ha evaporado completamente en el instante t=604 s
Tenemos que t1=78s y t2=604-78=526 s
La potencia efectiva P del hornillo eléctrico que se ha empleado en calentar y evaporar el agua es algo menos de 1000 W.
leyes de los gases
La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética (debida al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente proporcionales en la llamada "La segunda ley de Gay-Lussac".
La ley de Charles es una de las leyes más importantes acerca del comportamiento de los gases, y ha sido usada en muchas aplicaciones diferentes, desde para globos de aire caliente hasta en acuarios. Se expresa por la fórmula:
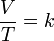
Donde:
- V es el volumen
- T es la temperatura absoluta (es decir, medida en Kelvin)
- k es la constante de proporcionalidad.
ley de charles:

ejemplo:
se tiene un gas a una temperatura de 25 grados centígrados, con un volumen de 70 centímetros cúbicos, a una presión de 586 mm de mercurio.
¿Qué volumen ocupara el gas a una temperatura de 0 grados centígrados?
datos:
t1=25c*> 298*
v1=70cms cuadrados v2= v1*t2 / t1
p1=586 mm de mercurio
t2=0c*> 273k* v2=19,110/ 298
v2=64.12 cms cúbicos v2= 64.12 cms cúbicos
ley de gay-Lussac
p1= p2
__ __
t1 t2
ejemplo:
un balón de futbol recibe una presión de 7.8 astmosferas, con una temperatura de 19 grados centígrados, si el balón incrementa su temperatura a 25 grados centígrados ¿Cuál será su presión absoluta?
datos:
p1=7.8 atmosferas p2= p1* t2 / t1
t1= 19c*> 292k*
t2= 25c*> 298k* p2=7.8 atms* 298k* /292k*
p2= 7.96 atms.
p2= 7.96 atmosferas
ley de boyle
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandés Robert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.Matemáticamente se puede expresar así:
donde
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:ley de boyle:
p1 = p2
__ __
v1 v2
ejemplo:
un gas ocupa un volumen de 200 centímetros cúbicos, a una presión de 560 mm de mercurio, con una temperatura de 20 grados centígrados ¿Cuál será su volumen si la presión aumenta a 1,000 mm de mercurio?
datos. v2= 560* 200 / 1000 mm de hg
v1= 200 cms cúbicos
p1= 560 mm de mercurio v2= 112,000/ 1,000
t1= 20c*
p2= 1,000 mm de mercurio v2= 112 cms cubicos
v2= 112 cms cubicos
termodinámica
es la rama de la física que describe los estados de equilibrio a nivel macroscópico. Constituye una teoría fenomenológica, a partir de razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental. Los estados de equilibrio son estudiados y definidos por medio de magnitudes extensivas tales como la energía interna, la entropía, el volumen o la composición molar del sistema, o por medio de magnitudes no-extensivas derivadas de las anteriores como la temperatura, presión y el potencial químico; otras magnitudes tales como la imanación, la fuerza electromotriz y las asociadas con la mecanica de los medios continuos en general también pueden ser tratadas por medio de la termodinámica.
leyes de la termodinámica
Principio cero de la termodinámica
Este principio o ley cero, establece que existe una determinada propiedad denominada temperatura empírica θ, que es común para todos los estados de equilibrio termodinámico que se encuentren en equilibrio mutuo con uno dado.En palabras llanas: «Si pones en contacto un objeto con menor temperatura con otro con mayor temperatura, ambos evolucionan hasta que sus temperaturas se igualan».
Tiene una gran importancia experimental «pues permite construir instrumentos que midan la temperatura de un sistema» pero no resulta tan importante en el marco teórico de la termodinámica.
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir o dar a conocer un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, coordenadas en el plano x, y) no son dependientes del tiempo. El tiempo es un parámetro cinético, asociado a nivel microscópico; el cual a su vez está dentro de la físico química y no es parámetro debido a que a la termodinámica solo le interesa trabajar con un tiempo inicial y otro final. A dichas variables empíricas (experimentales) de un sistema se las conoce como coordenadas térmicas y dinámicas del sistema.
Este principio fundamental, aún siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibiese el nombre de principio cero.
Primera ley de la termodinámica
También conocida como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.En palabras llanas: "La energía no se crea ni se destruye: solo se transforma".
Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica.
La ecuación general de la conservación de la energía es la siguiente
Segunda ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el primer principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía, de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero.Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
Tercera ley de la termodinámica
Algunas fuentes se refieren incorrectamente al postulado de Nernst como "la tercera de las leyes de la termodinámica". Es importante reconocer que no es una noción exigida por la termodinámica clásica por lo que resulta inapropiado tratarlo de «ley», siendo incluso inconsistente con la mecánica estadística clásica y necesitando el establecimiento previo de la estadística cuántica para ser valorado adecuadamente. La mayor parte de la termodinámica no requiere la utilización de este postulado. El postulado de Nernst, llamado así por ser propuesto por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto.Es importante remarcar que los principios o leyes de la termodinámica son válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel microscópico. La idea del demonio de Maxwell ayuda a comprender los límites de la segunda ley de la termodinámica jugando con las propiedades microscópicas de las partículas que componen un gas
energía cinetica
La energía cinética es la energía que un objeto posee debido a su movimiento. La energía cinética depende de la masa y la velocidad del objeto según la ecuación
E = (1/2)mv2
donde m es la masa del objeto y v2 la velocidad del mismo elevada al cuadrado. El valor de E también puede derivarse de la ecuación
E = (ma)d
donde a es la aceleración de la masa m y d es la distancia a lo largo de la cual se acelera. Las relaciones entre la energía cinética y la energía potencial, y entre los conceptos de fuerza, distancia, aceleración y energía, pueden ilustrarse elevando un objeto y dejándolo caer.Cuando el objeto se levanta desde una superficie se le aplica una fuerza vertical. Al actuar esa fuerza a lo largo de una distancia, se transfiere energía al objeto. La energía asociada a un objeto situado a determinada altura sobre una superficie se denomina energía potencial. Si se deja caer el objeto, la energía potencial se convierte en energía cinética.
ejemplo:
calcular en jouls la energía cinetica que tiene una bala de 8 gramos si su velocidad es de 700 kilómetros por hora.
datos:
Ec=0.5 *m * v(2)
Ec= 0.5* 0.008* 194.44(2)
m=8gr>0.008 kg
v= 700km/h> 194.44 m/s Ec=151.224
ec=151.224 jouls
energía potencial gravitacional
En un sistema físico, la energía potencial es la energía que mide la capacidad que tiene dicho sistema para realizar un trabajo en función exclusivamente de su posición o configuración. Puede pensarse como la energía almacenada en el sistema, o como una medida del trabajo que un sistema puede entregar. Suele abreviarse con la letra u o ep.
La energía potencial puede presentarse como energía potencial gravitatoria, energía potencial electrostática, y energía potencial elástica.
Más rigurosamente, la energía potencial es una magnitud escalar asociada a un campo de fuerzas (o como en elasticidad un campotensorial de tensiones). Cuando la energía potencial está asociada a un campo de fuerzas, la diferencia entre los valores del campo en dos puntos A y B es igual al trabajo realizado por la fuerza para cualquier recorrido entre B y A.
formula:
EPG= P*H
P= M * G(9.81)
EJEMPLO:
calcular la energía potencial de una piedra de 785 gramos que cae de una altura de 6.5 metros.
EPG=7.70085*6.5
datos: EPG=50.055 JOULS
M=785GR> 0.785KG
H=6.5 MT
ley de coulomb
escribió las leyes que rigen la atracción y repulcion, de dos cargas eléctricas en reposo. una carga puntual es la que tiene distribuida un cuerpo electrizado que existe entre otro cuerpo cargada eléctricamente.
el observo que a mayor distancia entre dos cuerpos cargados eléctricamente, menor es la fuerza de atracción.
de acuerdo con sus observaciones coulomb establecio que ola fuerza de atracción o repulcion, entre dos cargas puntuales es inversamente proporcional al cuadrado de loa distancia que los separa.
formula:
f= k(q1*q2) / r(exp 2)
f=fuerza de atracción.
k=constante de coulomb 9*10(exp 9)
q1 y q2= cargas eléctricas.
r=distancia entre las cargas.
ejemplo:
calcular el valor de la fuerza eléctrica entre dos cargas cuyos valores son q1=2x10(exp-3), q2=4x10(exp-3)., al estar separadas por una distancia de 30 cms.
datos:
q1= 2x10(exp-3)
q2=4x10(exp-3)
k=9x10(exp 9)
r=30 cms> .3 mt
f=9x10(exp 9) (( 2x10(exp -.3) * 4x10(exp -3) )) / 0.15
f=0.00008888* 9x10(exp 9)
f=800,000
formula para sacar las cargas eléctricas:
q1 0 q2 = f* r / k* q1 o q2< según la carga eléctrica que se necesite sacar.
blog hecho por:
Pablo Emilio Barajas Alvarado 2-d t/m
Luis Oswaldo Salazar Alba 2-d t/m

